ЕЛЕКТРИЧНА ПРОВІДНІСТЬ (G, Ом–1 або сименс, См) — здатність електроліту в розчині проводити електричний струм під дією зовнішнього електричного поля. Вона чисельно рівна оберненій величині електричного опору R розчину речовини: G = 1 / R. Загальна Е.п. G не є стандартною величиною, тому на практиці використовують питому E.п.
П.Е.п. (k) — це провідність шару розчину, який знаходиться між однаковими електродами з площею поперечного перерізу 1 м2, розташованими на відстані 1 м, тобто це гіпотетична електропровідність 1м3 розчину електроліту. П.Е.п. залежить від природи речовини (заряду іонів, швидкості їх руху), концентрації розчину, температури і природи розчинника. Вплив природи електроліту на питому електричну провідність зумовлений різною швидкістю руху іонів та ступенем дисоціації електроліту. Підвищення температури призводить до зростання П.Е.п. і зниження опору розчинів електролітів. Температурні коефіцієнти П.Е.п. і в’язкості водних розчинів близькі за своїм розміром, але протилежні за знаком. Тому Е.п. розчинів вимірюють при сталій температурі. Однак на практиці П.Е.п. розчинів виражають у сименсах на сантиметр (См ∙ см–1) або мікросименсах на сантиметр (мкСм ∙ см–1), а питомого опору — Ом ∙ см. Зазвичай значення П.Е.п. або питомого опору наводять за температури 20 °С. Рекомендується як одиницю використовувати Ом–1 ∙ см–1, а не См ∙ см–1, оскільки внаслідок схожості позначень сименса та сантиметра зростає можливість помилок. Для перерахунку розмірності См ∙ см–1 у См ∙ м–1 при 298 К необхідно одержане значення помножити на 1 ∙ 10–2: [См ∙ м–1] = 1 ∙ 10–2 [См ∙ см–1]. Звідси молярна Е.п., L (См ∙ м2 ∙ моль–1) розчину, що містить речовину В, чисельно дорівнює частці від ділення П.Е.п на молярну концентрацію розчину речовини В:
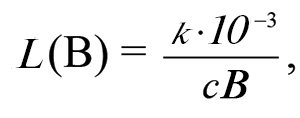
де сВ — молярна концентрація речовини В (моль/л).
На практиці молярну Е.п. розчинів виражають у См ∙ см2 ∙ моль–1 або мкСм ∙ см2 ∙ моль–1. Для перерахунку розмірності См ∙ см2 ∙ моль–1 у См ∙ м2 ∙ моль–1 при 298 К необхідно одержане значення помножити на 1 ∙ 10–4 : [См ∙ м2 ∙ моль–1] = 1 ∙ 10–4 [См ∙ см2 ∙ моль–1]. Запис молярної Е.п. рекомендується здійснювати таким чином: L (0,1 NaCl, Н2О, 298 К) або (∞ NaCl, Н2О, 298 К). L (В) слабких електролітів зростає при розбавленні в основному за рахунок підвищення кількості носіїв електрики — іонів, оскільки ступінь електролітичної дисоціації зі зниженням концентрації розчину зростає та досягає свого граничного значення (a → 1). При безмежному розбавленні розчинів рухливість іонів стає сталою, електропровідність безмежно розбавленого розчину електроліту дорівнює сумі граничних молярних Е.п. або граничних рухливостей катіонів λ∞+ та аніонів λ∞–: Λ∞ = λ∞++ λ∞–. Отже, гранична молярна Е.п., L∞ — це Е.п. гіпотетично безмежно розбавленого розчину, який характеризується повною дисоціацією електроліту і відсутністю сил електростатичної взаємодії між іонами. Для слабких електролітів, напр., ацетатної кислоти, експериментально знайти L∞ не вдається. Тому величину Λ∞ для слабких електролітів необхідно розраховувати.
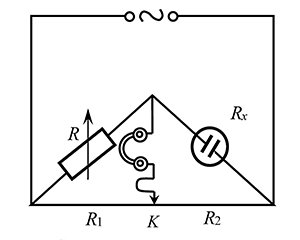
Рис. Схема мосту для вимірювання Е.п. електроліту: R – відомий опір; Rх – опір чарунки; R1 и R2 – опір плеч реохорду, яка представляє собою калібрований дріт, по якому ковзає контакт K; T – нуль-інструмент – телефон або осцилограф.
За способом виконання аналізу методом кондуктометрії розрізняють пряму кондуктометрію та кондуктометричне титрування. Метод прямої кондуктометрії ґрунтується на тому, що на ділянці розбавлених чи помірно концентрованих розчинів Е.п. зростає з підвищенням концентрації електроліту. Е.п. розчинів вимірюють за допомогою приладу — кондуктометра (омметра), принцип роботи якого заснований на вимірюванні активного опору стовпа рідини між двома зануреними в розчин електродами електропровідної чарунки. Вимірювання здійснюють зазвичай, використовуючи джерело змінного струму, що дозволяє уникнути поляризації електродів. Існують також сучасні прилади для високочастотної кондуктометрії, в яких використовують безконтактні ємнісні та індуктивні чарунки, а вимірювання Е.п. здійснюють за допомогою мостів опору Кольрауша, які живляться змінним струмом. Схема такого моста показана на рисунку. Як джерело змінного струму зазвичай використовують високочастотний генератор. Під час здійснення вимірювань переміщають ковзаючий контакт K по реохорду до моменту досягнення у колі мінімального струму, який фіксують за нуль-інструментом. У момент компенсації між опорами плеч мосту існує залежність R · R2 = Rx · R1, тобто Rx = R · R2 / R1. Опір чарунки Rx = r (lч / Sч) = (1 / k) (lч / Sч) (де r і k — відповідно питомий опір у Ом · м і питома електропровідність розчину в чарунці, См/м; lя — відстань між електродами у чарунці, у м; Sя — переріз площі проходження електричного струму, у м2), а П.Е.п. розчину у чарунці визначається за рівнянням: k = (1 / Rx) (lч / Sч) = (1 / Rx) / К, де К = lч / Sч (м–1). Силові лінії в електричному полі розподіляються нерівномірно, і щільність струму в різних перерізах розчину неоднакова. Струм проходить не лише через поверхню електродів, повернутих один до одного, але і через прилеглий до них розчин. Розподіл силових ліній в електричному полі залежить від форми, розмірів і взаємного розташування електродів. Виготовлення чарунок, у яких площа електродів та відстань між ними точно відомі, значно утруднене, тому відношення К = lя / Sя розглядають як сталу величину (стала чарунки) і визначають експериментально, вимірюючи опір чарунки, заповненої розчином з наперед відомою Е.п., зазвичай 0,1 моль/л розчином калій хлориду при температурі 20±0,1 °С. К = RKCl · kKCl, де RKCl — опір, виміряний у мегомах; kKCl — Е.п. використовуваного стандартного розчину калій хлориду Р, у мкСм ∙ см–1. Виміряне значення сталої чарунки К не має відрізнятися від зазначеного більше як на 5%.
У практичній роботі зазвичай використовують наперед побудовану градуювальну криву залежності Е.п. розчину від концентрації тих чи інших електролітів. За градуювальним графіком знаходять концентрацію індивідуальних речовин у розбавлених розчинах, де зберігається лінійна залежність k = f(c). Незважаючи на порівняно високу точність, метод не знайшов широкого застосування в аналітичній практиці та фармацевтичному аналізі. У зв’язку з відносно близькими значеннями рухливостей іонів кондуктометричні вимірювання дають інформацію головним чином лише про загальну концентрацію іонів у розчині. Мала селективність кондуктометричного методу суттєво обмежує його практичне застосування.
Кондуктометричне титрування — це електрохімічний метод аналізу розчинів, заснований на реєстрації змін Е.п. випробуваного розчину у процесі титрування. При кондуктометричному титруванні кінцева точка титрування визначається за зламом на кривій «Е.п. розчину — об’єм доданого титранта» графічним способом. Під час так званого хронокондуктометричного титрування аналіз здійснюється при сталій швидкості додавання титранта, а концентрацію визначають за кривою «Е.п.розчину — час титрування». Застосування титранта, здатного взаємодіяти лише з певним іоном, підвищує селективність методу.
Так, методом прямої кондуктометрії виконують визначення іонних компонентів у субстанції водовмісного неіонного низькомолекулярного водорозчинного ЛП для внутрішньосудинного та інших способів уведення йогексолу — 5-[(ацетил)(2,3-дигідроксипропіл)аміно)]-N,N-біс(2,3-дигідроксипропіл)-2,4,6-трі-йодбензол-1,3дикарбоксиаміду. Вимірюють П.Е.п. випробуваного та стандартного розчинів. П.Е.п. випробуваного розчину не повинна перевищувати П.Е.п. стандартного розчину. За таких умов вміст іонних компонентів у перерахунку на вміст натрій хлориду Р у субстанції ПЛ не повинен перевищувати 0,05%.
Блажеєвський М.Є., Бондаренко Н.Ю. Застосування Міжнародної системи фізичних величин у хімії: Метод. рек. для студ. вищ. фармац. закл. — Х.: НФаУ, 2015. — 35 с.
