Літій (Li, Lithium < грец. lithos — камінь) — хімічний елемент групи періодичної системи Д.І. Менделєєва, належить до лужних металів, ат. н. 3, ат. м. 6,941. Складається з двох стабільних ізотопів 6Li (7,52%) та 7Li (92,48%). Конфігурація зовнішньої електричної оболонки 2s1, с.о. +1, енергія іонізації Li0 → Li+ 5,391 еВ; спорідненість до електрона 0,598 еВ; електронегативність за Полінгом 0,95; ат. радіус 0,157 нм, іонний радіус Li+ (у дужках вказані координаційні числа) 0,073 нм (4), 0,090 нм (6), 0,106 нм (8).
Вміст літію у земній корі 6,5·10–3% за масою. Основні мінерали — сподумен, лепідоліт, петаліт. Загальні запаси Li2O у надрах і водах зарубіжних країн, за винятком Світового океану, становлять близько 24 млн т (Росія, США, Канада, Чилі, Зімбабве, Бразилія, Намібія).
Літій — сріблясто-білий, найлегший із металів, густина 0,534 г/см3, Tпл=180,5 °С. Хімічні реакції літію проходять менш енергійно, ніж у інших лужних металів. З абсолютно сухим повітрям він практично не реагує при кімнатній температурі і окиснюється в ньому лише при нагріванні. У вологому повітрі утворює переважно Li3N, при вологості повітря більше 80% — LiOH та Li2CO3. Із сухим О2 при кімнатній температурі не реагує, при нагріванні горить блакитним полум’ям із утворенням Li2O. З водою реагує, утворюючи LiOH та Н2 без плавлення та спалаху, а розплав Л. при контакті з водою вибухає. Л. безпосередньо реагує з F2, Cl2, Br2, а при нагріванні — з І2. З розведеними кислотами бурхливо взаємодіє, утворюючи солі та Н2. З рідким NH3 повільно реагує, утворюючи LiNH2 та Н2. З Н2 при 500 °С дає літію гідрид LiH. Л. започатковує ряд напруг, його нормальний потенціал — 3,02 В, електродний потенціал Л. у розплаві — 2,1 В. Пара Л. забарвлює полум’я у карміново-червоний колір. У всіх відомих сполуках літій одновалентний. Іон літію характеризується найбільшим коефіцієнтом поляризації (1,64) та найменшим коефіцієнтом поляризованості (0,075) серед усіх лужних металів, це визначає особливе положення літію серед них і його подібність до лужноземельних металів, особливо до магнію, іонний радіус якого (0,74 А) лише незначно відрізняється від іонного радіуса літію. У водному розчині літій гідратований більше, ніж іони інших лужних елементів і має найбільший радіус та найменшу рухливість. Оксигенвмісні сполуки Л. з азотом — літію нітрат та нітрит LiNO2, який може бути одержаний відновленням нітрату і є легкорозчинною у воді та абсолютному спирті сполукою, що розкладається при 185 °С (до плавлення). Із фосфором Л. безпосередньо не реагує, фосфід змінного складу (LinPm) утворюється внаслідок взаємодії карбіду літію з парою фосфору. Л. утворює численні середні та кислі солі з фосфатними кислотами. Найважливішою сполукою є Л. ортофосфат (Li3PO4) — одна із найменш розчинних солей Л., використовується для вилучення Л. із розчинів малих концентрацій (маточників літієвих виробництв). При нагріванні Л. легко реагує з графітом, утворюючи карбід Li2C2, похідний ацетилену; Li2C2 одержують відновленням Л. карбонату вугіллям в електричній печі або з елементів у вакуумі.
Карбід літію — сильний відновник, дисоціює при нагріванні на Л. та графіт. При нагріванні надлишку літію з кремнієм утворюється літій силіцид, склад якого нез’ясований. При 600 °С у вакуумі силіцид Л. розкладається на вихідні компоненти. При температурі червоного шару літію силіцид легко відновлює Fe, Mn, Al із їх оксидів. Літій — компонент численних сплавів. З деякими металами (Mg, Zn, Al) він утворює тверді розчини значної концентрації, з багатьма металами (Al, Zn, Mg, Cd, Hg, Tl, Pb, Bi, Ag, Sn) — інтерметаліди. Останні часто характеризуються високою твердістю і тугоплавкістю, незначно змінюються на повітрі, для деяких характерні напівпровідникові властивості. На сьогодні вивчені бінарні системи, утворені літію більше ніж з 30 елементами. Технічне значення мають сплави літію з Al, Mg, Pb, Zn, Cu, та Ca. Вміст літію у більшості сплавів невеликий; додавання близько 1% Li покращує властивості основного металу, надаючи йому в’язкості або твердості та корозійної стійкості. Руди Л. містять 0,25–3,0% Л. оксиду, тому вимагають збагачення з метою одержання концентратів промислових мінералів. Мінерали літію, залежно від складу, обробляють H2SO4 (кислотний спосіб), K2SO4 (сольовий спосіб), СаСО3 та СаСІ2 (лужно-сольовий спосіб). Усі ці методи, окрім лужного, передбачають одержання готового продукту у вигляді Li2CO3, який є джерелом для синтезу інших сполук. Металічний Л. одержують електролізом розплавлення cуміші LiCl та KCl (або BaCl2) з очищенням від домішок вакуумною дистиляцією, ректифікацією чи зонною плавкою. Якісно літій виявляють за карміново-червоним забарвленням полум’я, леткими сполуками літію та за найбільш чітко вираженими спектральними лініями Л.: 670,78 і 610,36 нм. Кількісно літій визначають полум’яно-фотометричним, спектрографічним та гравіметричним методами.
Літій використовують у виробництві анодів для хімічних джерел струму на основі неводних і твердих електролітів, як компонент сплавів з Mg та Al, антифрикційних сплавів (бабітів), сплавів із Si для виготовлення холодних катодів у електровакуумних приладах; для розкиснення, дегазації, модифікування та рафінування Сu, мідних, цинкових, нікелевих сплавів з метою покращання їх структури та підвищення електричної провідності; як каталізатор полімеризації (напр. ізопрену), ацетилювання та ін. Рідкий літій — теплоносій у ядерних реакторах. Ізотоп 6Li використовують для одержання тритію за реакцією:
63Li + 10n = 31H + 42He.
Літій широко використовують у силікатній промисловості, в якій застосовуються спеціально одержані сполуки Л. (алюмінат, кобальтат, манганат, молібдат, силікат, титанат, цирконат, метаборат та ін.), а також фторид і карбонат. Літій та його сполуки використовують у виробництві каталізаторів і стабілізаторів пластмас, у техніці очищення газів, текстильній промисловості (вибілювання тканин, просякнення тканин з метою водонепроникності), харчовій промисловості (консервування м’яса, виготовлення напоїв), сільському господарстві (інсектициди, фунгіциди, стимулятори росту рослин). Досить широко використовуються сполуки Л. також у виробництві фармацевтичних препаратів і косметичної продукції.
Вплив сполук літію на організм людини мало з’ясований. Літій входить до деяких органів і м’язів. Виявлено накопичення літію у м’язах при скороченні міокарда серця. Здатність бензоату літію утворювати з сечовою кислотою розчинні солі, які легко виводяться із організму, використовують для видалення каменів із нирок.
Високі концентрації літію викликають денатурацію білків унаслідок прямої дії на пептидні зв’язки та за рахунок зневоднення. Літій бере участь у метаболізмі нітрогенвмісних сполук, в т.ч. білків і генетично зв’язаних з ними нуклеїнових кислот. Л. — біогенний елемент, оскільки він суттєво впливає на набухання і відбухання колоїдів протоплазми та на ступінь упорядкування структури води. Л. нейтралізує негативний заряд фосфатної групи ДНК і сприяє тим самим стабілізації її вторинної структури. Сполуки Л. використовуються в медицині як психотропні препарати. Вони впливають також на мікрофлору ґрунту, захищають, напр. пшеницю від борошнистої роси та іржі.
Овочі, що містять літій:
- столовий буряк;
- кабачки;
- редька чорна;
- морква;
- картопля;
- пшоно.
У медичній практиці як антидепресант застосовують літій карбонат (Lithii karbоnas): Li2CO3. Солі Л. знижують гостре маніакальне збудження. Ефект психотропного впливу зумовлений впливом літію на нейрохімічні процеси головного мозку, а також покращанням транспорту іонів Натрію у нервових та м’язових клітинах. Літій — антагоніст Натрію. Під його впливом посилюється внутрішньоклітинне дезамінування норадреналіну та зменшується кількість вільного норадреналіну, який знижує вміст серотоніну у великих півкулях головного мозку. Іони літію підвищують чутливість нейронів гіпокампу до дії дофаміну. Він знижує інтенсивність клітинного дихання нейронів і пригнічує активність нейрональних дегідрогеназ. Цей процес найбільше виражений в емоціогенних структурах лімбічної системи.
Солі літію застосовують при маніакально-депресивному психозі, шизофренії, хронічному алкоголізмі, епілепсії, депресивних станах різного генезу, функціональних психічних розладах. До ЛП пролонгованої дії, що містять літій карбонат, належить «Мікаліт». Ноотропну дію виявляє оксибутират літію. За хімічною структурою Л. оксибутират (Litii oxybutyras) є літієвим аналогом натрій оксибутирату:
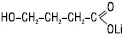
Лікувальна дія препарату пов’язана з наявністю у молекулі іона літію. Препарат має також елементи активності, характерні для оксибутират-іона: спричиняє седативну дію. Порівняно з Л. карбонатом Л. оксибутират більш активний, але менш токсичний. Оскільки препарат розчинний, його можна вводити в/м. Застосовують літію оксибутират, як і літію карбонат, при гіпоманіакальних і маніакальних станах та для профілактики нападів афективних розладів, а також при психопатіях, неврозах.
Лекарственные препараты Украины 1999–2000: В 3 т. — Х., 1999. — Т. 2; Тринус Ф.П. Фармакотерапевтический справочник. — К., 1989; Чекман И.С., Пелащук Ф.П., Пятак О.А. и др. Справочник по клинической фармакологии. — К., 1987.
