ОСМОЛЯРНІСТЬ (осмоляльність) — показник якості парентеральних та очних розчинів, який використовується для характеристики їх осмотичного тиску і позначається Os. O. — концентрація осмотично активних частинок (осмолютів) у розчині, виражена через осмолі розчиненої речовини на літр розчину. Одиницею О. є осмоль на літр розчину (осмоль/л) або в тисячу разів менша величина — міліосмоль на літр (мосмоль/л). Отже, О. — це концентрація осмотично активних частинок у розчині, виражена через осмолі розчиненої речовини на кілограм розчинника. Одиницею осмоляльності є осмоль на кілограм розчинника (осмоль/кг), але на практиці зазвичай використовується міліосмоль на кілограм розчинника (мосмоль/кг). Осмоль (Osm) — кількість речовини, яка дисоціює в розчині з утворенням 1 моля осмотично-активних частинок (осмолютів), напр. 1 моль глюкози, яка не здатна до дисоціації, утворює 1 осмоль розчиненої речовини, але 1 моль натрій хлориду утворює 2 осмолі розчиненої речовини і позначається 2 Osm. Для ідеальних розчинів маса осмоля речовини дорівнює відношенню молярної маси речовини у г на моль до числа частинок — молекул або іонів, які утворюються при розчиненні або внаслідок розчинення та дисоціації. У розбавлених розчинах, близьких до ідеальних, значення величин О. та осмоляльності збігаються. О. і осмоляльність прямо пропорційні колігативним властивостям розчину: осмотичному тиску, зниженню Тзамерз розчину (депресії, ΔТ), підвищенню Ткип розчину і зниженню тиску пари розчинника над розчином.
Оскільки водні рідкі ЛП готуються масово-об’ємним способом, більш доцільним є розрахунок О. У складних розчинах цей показник дозволяє оцінити сумарний внесок розчинених лікарських речовин в осмотичний тиск розчину. Розрахунок О.водного розчину здійснюють за формулою:
Os=і•с,
де і — ізотонічний коефіцієнт (коефіцієнт Вант-Гоффа) (див. Ізотонічний коефіцієнт (коефіцієнт Вант-Гоффа)); с — молярна концентрація розчиненої речовини у моль на л розчину (для розбавлених розчинів молярна концентрація може бути замінена на моляльну — у моль на кг розчинника). При підвищенні концентрації розчину взаємодія між частинками речовини зростає й реальна О. знижується порівняно з О. ідеального розчину. О. визначають за ΔТ, якщо немає інших зазначень в окремій статті. Залежність між О. у мосмоль/кг і ΔТ виражають співвідношенням:
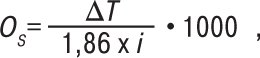
де 1,86 — кріоскопічна стала для води. О. визначають за допомогою приладу осмометра. Результати вважаються вірогідними, якщо одержане значення випробуваного розчину не виходить за межі значення осмоляльності двох стандартних розчинів, використаних для калібрування. Для розбавлених розчинів, близьких до ідеальних, обидві величини можуть бути розраховані теоретично. Розрахунки О. у мосмоль на л ідеальних розчинів згідно з ДФУ здійснюють за формулою:
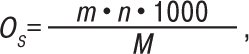
де m — маса розчиненої речовини, г/л; n — число частинок, що утворюються з однієї молекули речовини при дисоціації; M — мол. м. речовини. У багатокомпонентному розчині для розрахунку О. необхідно враховувати О., яку створює кожен компонент окремо, та підсумовувати одержані результати. Теоретичний розрахунок О. розчинів із великою мол. м. (білкові гідролізати) і для висококонцентрованих розчинів неможливий. У таких випадках визначають О. експериментальним шляхом за ΔТ або за зниженням тиску пари розчинника над розчином.
Визначення О. розчинів важливе при застосуванні інфузійних розчинів для парентерального живлення організму, регулюванні порушень водно-електролітного і кислотно-основного балансу, боротьби із загрозливими для життя станами (шок, набряк мозку, серцева недостатність тощо), коли необхідно проводити тривалу інфузійну терапію, тому що одна з вимог до цих розчинів — ізотонічність (див. Ізотонічні розчини). Розчини, що дорівнюють за О. в еквівалентній концентрації 0,9% розчину натрій хлориду (300 мосмоль/л), називають ізотонічними. На здорове око не виявляють больового впливу розчини з О. в еквівалентній концентрації натрій хлориду в інтервалі 0,6–2%, що відповідає 220–680 мосмоль/л. Значення О. необхідно помічати на етикетках інфузійних розчинів.
ДФУ. — Х., 2001; Тихонов О.І., Ярних Т.Г. Аптечна технологія ліків. — Х., 2006; Фізична та колоїдна хімія / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін. — Х., 1999.
