Концентрація розчинів — це величина, яку вимірюють масою або об’ємом розчиненої речовини, що міститься у певній масі або об’ємі розчину або розчинника. Найчастіше використовують такі способи вираження концентрації: масова частка, молярна, моляльна концентрація, молярна концентрація еквівалента, молярна частка, об’ємна частка та титр. Масову частку речовини Х w(Х) розраховують за формулою:

де m(X) — маса розчиненої речовини Х (в кг, г); m — маса розчину (в кг, г). Її виражають у частках одиниці або в %. В останньому випадку розрахунок здійснюють за формулою:
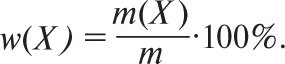
Масову частку у відсотках називають масовим відсотком (маса речовини в г у 100 г розчину і позначають% м/м (% w/w, англ.)). Тисячну частку розчину називають промілє і позначають ‰. 1‰=1:103=10–1% (г/кг, мг/г). Концентрації слідів компонентів в аналітичній хімії прийнято виражати в частинах на мільйон — ppm (parts реr million) або в частинах на мільярд — ppb (parts реr billion). ppm=млн-1=1:106=10–4%(мкг/г, мг/кг); ppb=млрд-1=1:109=10–7%(нг/г, мкг/кг).
Об’ємну частку розраховують за формулою, аналогічною для розрахунку масової частки, замінивши маси на відповідні об’єми. Об’ємний відсоток позначають% об/об (% v/v, англ.). Ваго-об’ємну частку розраховують діленням маси розчиненої речовини m(X) на об’єм розчину V, тобто: ![]()
Ваго-об’ємний відсоток позначають% м/ об (% w/v, англ.). Молярну концентрацію речовини Х с(Х) виражають кількістю розчиненої речовини n(X), яка міститься у певному об’ємі розчину (моль/м3, моль/дм3, моль/ см3, моль/л, моль/мл). В аналітичній хімії найбільш часто використовують одиниці моль/л. Молярну концентрацію розраховують за формулою:
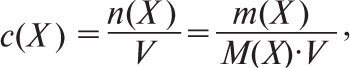
де n — кількість речовини Х; m(Х) — маса розчиненої речовини, M(Х) — молярна маса розчиненої речовини, V — об’єм розчину. Дотепер в аналітичній хімії широко застосовують умовні або реальні частки речовини Х, названі еквівалентом. Якщо кількість розчиненої речовини n(X) визначають за вмістом еквівалентів цієї речовини у розчині ![]() де Е(Х) — молярна маса еквівалента), то використовують поняття молярної концентрації еквівалента (нормальної концентрації), яку також позначають символом с. Під хімічним еквівалентом розуміють умовні (реально не існуючі) або реальні частинки у z разів (еквівалентне число) менші, ніж відповідні формульні одиниці. Еквівалентне число z(Х) показує, яке число еквівалентів речовини (Х) умовно міститься в одній формульній одиниці цієї речовини. Еквівалентне число z може бути приписане речовині, якщо відомо, в якій конкретній хімічній реакції вона бере участь (воно може бути постійним або змінюватися залежно від типу реакції). Напр., залежно від умов KMnO4 може відновлюватися до солей Mn2+ (MnSO4) або до MnO2. У першому випадку z буде дорівнювати 5, а в другому — 3. Молярну масу еквівалента речовини Е(Х) визначають за формулою
де Е(Х) — молярна маса еквівалента), то використовують поняття молярної концентрації еквівалента (нормальної концентрації), яку також позначають символом с. Під хімічним еквівалентом розуміють умовні (реально не існуючі) або реальні частинки у z разів (еквівалентне число) менші, ніж відповідні формульні одиниці. Еквівалентне число z(Х) показує, яке число еквівалентів речовини (Х) умовно міститься в одній формульній одиниці цієї речовини. Еквівалентне число z може бути приписане речовині, якщо відомо, в якій конкретній хімічній реакції вона бере участь (воно може бути постійним або змінюватися залежно від типу реакції). Напр., залежно від умов KMnO4 може відновлюватися до солей Mn2+ (MnSO4) або до MnO2. У першому випадку z буде дорівнювати 5, а в другому — 3. Молярну масу еквівалента речовини Е(Х) визначають за формулою
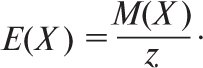
Величину 1/z позначають fекв(X) і називають фактором еквівалентності. Тому ![]() Для визначення z в обмінних реакціях необхідно визначити сумарний заряд тих іонів, які реагують з однією формульною одиницею відповідного реагенту. Напр., в обмінній реакції Cr3+ + 6(OH—) = [Cr(OH)6]3-, z(Cr3+) = 6, оскільки з одним іоном Cr3+ реагує 6 однозарядних іонів OH– (загальний заряд дорівнює 6, z(OH–)=1, z([Cr(OH)6]3–=6)). У реакції H2SO4+NaOH=NaHSO4+H2O z(H2SO4)=1, оскільки на одну формульну одиницю H2SO4 припадає один іон OH– (z=1) або один іон Na+ (z=1). Якщо реакція перебігає за рівнянням H2SO4+2NaOH=Na2SO4+2H2O, z(H2SO4)=2, z(OH–)=1, z(Na+)=1, z(Na2SO4)=2. В окисно-відновних реакціях еквівалентні числа відновника та окисника визначають за кількістю електронів, які віддає одна формульна одиниця відновника або приймає одна формульна одиниця окисника — відповідно.
Для визначення z в обмінних реакціях необхідно визначити сумарний заряд тих іонів, які реагують з однією формульною одиницею відповідного реагенту. Напр., в обмінній реакції Cr3+ + 6(OH—) = [Cr(OH)6]3-, z(Cr3+) = 6, оскільки з одним іоном Cr3+ реагує 6 однозарядних іонів OH– (загальний заряд дорівнює 6, z(OH–)=1, z([Cr(OH)6]3–=6)). У реакції H2SO4+NaOH=NaHSO4+H2O z(H2SO4)=1, оскільки на одну формульну одиницю H2SO4 припадає один іон OH– (z=1) або один іон Na+ (z=1). Якщо реакція перебігає за рівнянням H2SO4+2NaOH=Na2SO4+2H2O, z(H2SO4)=2, z(OH–)=1, z(Na+)=1, z(Na2SO4)=2. В окисно-відновних реакціях еквівалентні числа відновника та окисника визначають за кількістю електронів, які віддає одна формульна одиниця відновника або приймає одна формульна одиниця окисника — відповідно.
Так для реакції K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 +7H2O +KCl
Cr2O72- + 14H+ + 6ē = 2Cr3+ +7H2O 1
2Cl— — 2ē = Cl2 3
z(K2Cr2O7)=6, z(CrCl3)=3, z(Cl—)=1, z(Cl2)=2,
![]()
Оскільки молярну концентрацію речовини Х та молярну концентрацію еквівалента цієї речовини позначають одним і тим же символом с, то після нього необхідно вказати у дужках, яка величина узята за моль. Напр., якщо символом с позначають молярну концентрацію KMnO4, то її записують с(KMnO4), якщо ж йдеться про молярну концентрацію еквівалента KMnO4, коли ![]() , то її позначають
, то її позначають ![]() . Молярну концентрацію еквівалента речовини Х розраховують за формулою
. Молярну концентрацію еквівалента речовини Х розраховують за формулою
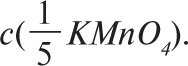
де n(fХ) — кількість речовини еквівалентів, моль; V — об’єм розчину, л. Одиниці вимірювання молярної концентрації речовини еквівалента — моль/м3, моль/дм3, моль/см3, моль/л, моль/мл. В аналітичній хімії частіше за все її виражають у моль/л. Між молярною концентрацією речовини Х і молярною концентрацією речовини еквівалента Х існує залежність с(X)=fеквc(fеквX) або ![]() Титр розчину речовини Х позначають T(Х); одиниці його вимірювання кг/см3, г/см3, г/мл. T(Х) розраховують за формулою
Титр розчину речовини Х позначають T(Х); одиниці його вимірювання кг/см3, г/см3, г/мл. T(Х) розраховують за формулою
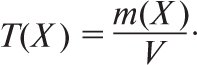
де m(Х) — маса речовини Х; V — об’єм розчину. Таким чином, титр розчину відповідає масі розчиненої речовини, яка міститься в 1 мл розчину. Титр титрованого розчину (титранта) за визначуваною речовиною T(Y/X) — маса речовини Х, яку визначають в г або в мг, вона еквівалентна 1см3 (1 мл) титранту Y з теоретичною молярною концентрацією або з теоретичною молярною концентрацією речовини еквівалента (розмірність г/см3, г/мл або мг/см3 мг/мл). Для титрованого розчину з теоретичною молярною концентрацією с(Y)теор. титр за визначуваною речовиною X розраховують за формулою
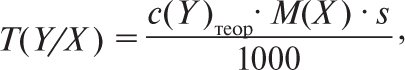
де M(X) — молярна маса речовини Х, s — стехіометричне співвідношення — величина, що показує, яка кількість молів визначуваної речовини припадає на 1 моль речовини титранта. Цю величину розраховують, виходячи з рівняння реакції. Напр., при титруванні розчину заліза (II) сульфату розчином KMnO4 (2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + 8H2O + K2SO4) величина s для FeSO4 буде дорівнювати ![]() Титр 0,02 молярного розчину KMnO4 за речовиною, що визначають FeSO4, розраховують за формулою
Титр 0,02 молярного розчину KMnO4 за речовиною, що визначають FeSO4, розраховують за формулою
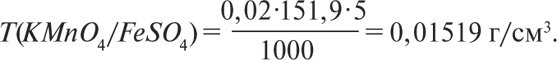
Таким чином, 1 см3 (1 мл) 0,02 М розчину KMnO4 еквівалентний 0,01519 г FeSO4. Якщо концентрація титрованого розчину виражена через молярну концентрацію еквівалента, то цю величину знаходять за формулою
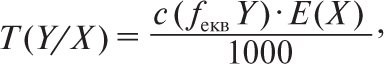
де с(fеквY) — молярна концентрація еквівалента речовини Y; Е(Х) — молярна маса еквівалента речовини Х. При цьому молярну концентрацію розчину KMnO4 (0,02 М), наведену вище, необхідно перевести у молярну концентрацію речовини еквівалента с ![]() за рівнянням:
за рівнянням: ![]() Звідки
Звідки ![]() Моляльна концентрація b(X) вказує, яка кількість речовини Х міститься в одному кг розчинника. Її розраховують за формулою
Моляльна концентрація b(X) вказує, яка кількість речовини Х міститься в одному кг розчинника. Її розраховують за формулою
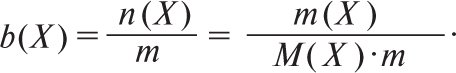
Одиниці її виміру моль/кг. Молярну частку x(Xi) виражають у частках одиниці або у відсотках та розраховують за формулою
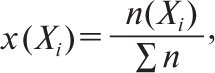
де n(Xi)— кількість речовини і-того компонента в розчині, моль; Σn— сумарна кількість усіх компонентів у розчині, моль. Об’ємну частку φ(X) розраховують за формулою
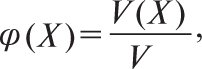
де V(X) — об’єм компонента в розчині, V — загальний об’єм розчину. Її виражають у частках одиниці або у відсотках. Міліграм процент (мг%) — маса речовини в мг, яка міститься в 100 мл розчину.
Номенклатурные правила ИЮПАК по химии, Т. 4 — М., 1985; Аналітична хімія / В.В. Болотов, О.М. Свечникова, С.В. Колісник та ін. — Х., 2004.
